 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
有一含NaClO3的未知溶液,取50.0ml以离子电极测定,当把1.00×10-2mol/L的NaClO3溶液加入被测试液中的体积分别
有一含NaClO3的未知溶液,取50.0ml以
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
有一含NaClO3的未知溶液,取50.0ml以
 答案
答案
 更多“有一含NaClO3的未知溶液,取50.0ml以离子电极测定,当把1.00×10-2mol/L的NaClO3溶液加入被测试液中的体积分别”相关的问题
更多“有一含NaClO3的未知溶液,取50.0ml以离子电极测定,当把1.00×10-2mol/L的NaClO3溶液加入被测试液中的体积分别”相关的问题
第1题
A.蓝紫色
B.深蓝色
C.褐色
D.黑色
第2题
0.0mL比色管内用邻二氮菲显色,定容后在510nm处测得吸光度如下:

取1.00mL含Fe2+未知溶液稀释到100.00mL,再取稀释液5.00mL,在50.0mL比色管内用同样方法显色定容后测得吸光度A=0.47.求未知溶液中Fe2+的浓度.
第3题
第4题
第5题
A.与NaOH反应的氯气一定为0.6 mol
B.n(Na+)∶n(Cl-) 可能为7:3
C.若反应中转移的电子为n mol,则0.3 n 0.5
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
第6题
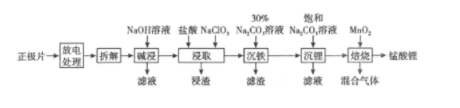 以废旧磷酸亚铁锂电池正极片(LiFePO4炭黑和铝箔等)为原料制备锰酸锂(LiMn2O4)的流程如图所示。回答下列问题:
以废旧磷酸亚铁锂电池正极片(LiFePO4炭黑和铝箔等)为原料制备锰酸锂(LiMn2O4)的流程如图所示。回答下列问题:
问题1、LiFePO4中Fe元素的化合价为;“放电处理”有利于锂在正极的回收,其原因是()。
问题2、“碱浸”中发生反应的离子方程式为()。
问题3、“浸取”中加入NaClO3的作用为;“沉铁”过程所得滤渣为白色固体,其主要成分是()。
问题4、已知碳酸锂的分解温度为723℃。当“焙烧”温度达到515℃时,开始有CO2产生,可能的原因是;MnO2可以利用MnSO4溶液与K2S2O8溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为()。
问题5、写出“焙烧”过程中生成锰酸锂的化学方程式。
第7题
A.滤渣1的主要成分只有SiO2,滤渣2可用于制备铁红
B.在氧化中,0.5 mol NaClO3最多能氧化4 mol Fe2+
C.在酸浸中发生的反应为Co3++Fe2+===Co2++Fe3+
D.用稀硝酸和AgNO3溶液可检验CoC2O4是否洗涤干净
第8题
用火焰原子吸收分光光度法测土壤中铜。称取风干过筛土样1.00 g(含水8.20%),经消解后定容至50.0 mL,用标准曲线法测得此溶液铜的浓度为0.700 mg/L,求被测土壤中铜的含量。
第9题
A.由步骤(1)可知,白色粉末中一定含碳酸钠和氢氧化钙
B.步骤(2)结束后所得溶液中溶质除酚酞外,只有氯化钠和氢氧化钠
C.该白色粉末的组成一定是碳酸钠、氢氧化钙和碳酸钙
D.该白色粉末中一定含碳酸钙
第10题
A.①③
B.②③
C.①④
D.②④